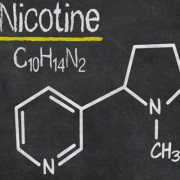
Аденозинтрифосфат — adenosine triphosphate
Содержание:
- функции
- цAMФ как вторичный посредник в сигнальной трансдукции
- Синтез АТФ
- История
- Как увеличить выработку АТФ
- Что такое АТФ
- Система гуанилатциклаза-цГМФ. Система фосфолипаза С — инозитол-3-фосфат.
- Роль цАМФ в бактериальных клетках[править | править код]
- Пути синтеза
- АТФ – универсальный источник энергии
- cAMP (цАМФ) Система
- Образование
- Сущность понятия
- История появления
- структура
- Медицинское применение Править
- Фотофосфорилирование
функции
АТФ играет незаменимую роль в энергетическом обмене практически всех живых организмов. По этой причине его часто называют энергетической валютой, поскольку его можно постоянно тратить и пополнять всего за несколько минут..
Прямой или косвенный, АТФ обеспечивает энергию для сотен процессов, в дополнение к действию в качестве донора фосфата.
В общем, АТФ действует как сигнальная молекула в процессах, происходящих внутри клетки, необходимо синтезировать компоненты ДНК и РНК и для синтеза других биомолекул участвует в трафике через мембраны, среди других.
Использование АТФ можно разделить на основные категории: транспорт молекул через биологические мембраны, синтез различных соединений и, наконец, механическая работа..
Функции СПС очень широки. Кроме того, он вовлечен в так много реакций, что было бы невозможно назвать их всех. Поэтому мы обсудим три конкретных примера, иллюстрирующих каждое из трех упомянутых применений..
Энергоснабжение для транспорта натрия и калия через мембрану
Ячейка является чрезвычайно динамичной средой, которая требует поддержания определенных концентраций. Большинство молекул не попадают в клетку случайно или случайно. Для того чтобы молекула или вещество могли проникнуть внутрь, оно должно делать это посредством своего конкретного переносчика..
Транспортеры — это белки, которые пересекают мембрану и функционируют как клеточные «привратники», контролирующие поток материалов. Следовательно, мембрана является полупроницаемой: она позволяет некоторым соединениям проникать, а другим — нет..
Одним из самых известных видов транспорта является натриево-калиевый насос. Этот механизм классифицируется как активный транспорт, так как движение ионов происходит против их концентрации, и единственный способ выполнить это движение — ввести энергию в систему в форме АТФ..
Подсчитано, что одна треть АТФ, образующегося в клетке, используется для поддержания работы насоса. Ионы натрия постоянно перекачиваются на поверхность клетки, а ионы калия — наоборот.
Логично, что использование АТФ не ограничивается транспортировкой натрия и калия. Есть другие ионы, такие как кальций, магний и другие, которые нуждаются в этой энергетической валюте, чтобы войти.
Участие в синтезе белка
Молекулы белка образованы аминокислотами, связанными между собой пептидными связями. Для их формирования требуется разрыв четырех высокоэнергетических связей. Другими словами, для образования белка средней длины необходимо гидролизовать значительное количество молекул АТФ..
Синтез белков происходит в структурах, называемых рибосомами. Они способны интерпретировать код, которым обладает РНК-мессенджер, и транслировать его в аминокислотную последовательность, АТФ-зависимый процесс.
В наиболее активных клетках синтез белка может направлять до 75% АТФ, синтезированного в этой важной работе. С другой стороны, клетка не только синтезирует белки, она также нуждается в липидах, холестерине и других необходимых веществах, и для этого требуется энергия, содержащаяся в связях АТФ.
С другой стороны, клетка не только синтезирует белки, она также нуждается в липидах, холестерине и других необходимых веществах, и для этого требуется энергия, содержащаяся в связях АТФ..
Обеспечить энергию для передвижения
Механическая работа является одной из важнейших функций СПС. Например, чтобы наше тело могло выполнять сокращение мышечных волокон, необходимо наличие большого количества энергии..
В мышцах химическая энергия может быть преобразована в механическую энергию благодаря реорганизации протеинов с сокращающей способностью, которые ее формируют. Длина этих структур изменена, укорочена, что создает напряжение, которое приводит к генерации движения.
У других организмов движение клеток также происходит благодаря наличию АТФ. Например, движение ресничек и жгутиков, которое позволяет перемещать определенные одноклеточные организмы, происходит посредством использования АТФ.
Другое конкретное движение — амебное, которое включает в себя выпячивание псевдоподы на концах клетки. Несколько типов клеток используют этот механизм локомоции, включая лейкоциты и фибробласты.
В случае половых клеток локомоция необходима для эффективного развития эмбриона. Эмбриональные клетки перемещаются на значительные расстояния от места их происхождения до региона, в котором они должны создавать специфические структуры..
цAMФ как вторичный посредник в сигнальной трансдукции
цAMФ осуществляет функции вторичного внутриклеточного посредника в действии первичных посредников (веществ, имеющих короткий период биодеградации) — например, ряда гормонов и нейромедиаторов. цAMФ опосредует биологическую функцию гормонов путём активации (инактивации) клеточных протеинкиназ (фосфатаз). Протеинкиназы, в свою очередь, фосфорилируют эффекторные белки и изменяют (увеличивают или уменьшают) их активность.
При активации аденилатциклазы, катализирующей образование цAMФ из АТФ, или блокировании фосфодиэстеразы, осуществляющей деградацию этого цAMФ, концентрация цAMФ в клетке увеличивается. Таким образом, содержание цАМФ в клетке определяется соотношением активностей этих двух ферментов. Связь между гормоном или др. химическим сигналом (первый посредник) и цAMФ (второй посредник) осуществляет аденилатциклазный комплекс, включающий рецептор, настроенный на определённый гормон (или др. биологически активное вещество) и расположенный на внешней стороне клеточной мембраны, и аденилатциклазу, расположенную на внутренней стороне мембраны. Гормон, взаимодействуя с рецептором, активирует аденилатциклазу, которая образует цAMФ из АТФ.
Концентрация цAMФ, образующегося в клетке, превышает концентрацию действующего на клетку гормона в 100 раз. В основе механизма действия цAMФ в тканях животных и человека лежит его взаимодействие с протеинкиназами, например, протеинкиназы А. Связывание цAMФ с регуляторной субъединицей протеинкиназы приводит к диссоциации фермента и активации его каталитической субъединицы, которая, освободившись от регуляторной субъединицы, способна фосфорилировать определённые белки (в том числе ферменты). Изменение свойств этих макромолекул путём фосфорилирования меняет и соответствующие функции клеток. цAMФ играет определённую роль в морфологии, подвижности, пигментации клеток, в кроветворении, клеточном иммунитете, вирусной инфекции и др.
Синтез АТФ
АТФ располагается в цитоплазме, ядре, хлоропластах, в митохондриях. Синтез АТФ в животной клетке происходит в митохондриях, а в растительной – в митохондриях и хлоропластах.
АТФ образуется из АДФ и фосфата с затратой энергии. Такой процесс называется фосфорилированием:
АДФ + Н3РО4 + энергия → АТФ + Н2О
Рис. 3. Образование АТФ из АДФ.
В растительных клетках фосфорилирование происходит при фотосинтезе и называется фотофосфорилированием. У животных процесс протекает при дыхании и называется окислительным фосфорилированием.
В животных клетках синтез АТФ происходит в процессе катаболизма (диссимиляции, энергетического обмена) при расщеплении белков, жиров, углеводов.
История
Ампулы первитина из Германии. Вводился внутримышечно, подкожно или медленно внутривенно.
Впервые синтезирован из эфедрина в 1893 году японским химиком . В 1919 году японским химиком Акирой Огатой был впервые синтезирован кристаллический метамфетамин.
Использование в Германии
В 1930-е годы фармацевты фирмы в Берлине использовали его как стимулирующее средство, получившее коммерческое название «первитин» (нем. Pervitin). Начиная с 1938 года его применяли систематически и в больших дозах, как в армии, так и в оборонной промышленности (таблетки первитина официально входили в «боевой рацион» лётчиков и танкистов под названием нем. «Panzerschokolade» — танковый шоколад). Накануне вторжения во Францию военнослужащим Вермахта было выдано 35 миллионов доз первитина.
Популярностью первитин пользовался и у вождей Третьего рейха, наряду с кокаином. В частности, Гитлер получал инъекции первитина от своего личного врача Теодора Морелля начиная с 1936 года, а после 1943 — по нескольку раз в день. Благодаря инъекциям первитина Гитлер был более общительным, энергичным, физически активным и бодрствовал поздно ночью.
Использование в США
После Второй мировой войны производители первитина были вывезены в США, где создавали «таблетки бодрости» для войск в Корее и Вьетнаме. В 1966—1969 годах армия США использовала 225 миллионов таблеток декстроамфетамина и первитина[источник не указан 936 дней].
Пентагон официально разрешил использовать амфетамины служащим в войсках. Они основывались на государственных испытаниях в 1940-х и ранних 1950-х годах, которые показали увеличение умственной деятельности лётчиков на 5 % при использовании метамфетамина. Первыми испытали на себе действие психостимулятора Военно-воздушные силы, затем в 1960 Стратегическое командование ВВС, в 1962 — Тактическое авиационное командование.
Во время Войны во Вьетнаме амфетамины стали доступны в таблетированной форме для всех видов войск.
Ветераны США жаловались на бессонницу, нервозность и потерю аппетита. В качестве контрмеры им предписали использовать дополнительно барбитураты.
Использование в Японии
Во время Второй мировой войны метамфетамин был широко распространён среди военных Императорской армии Японии. На момент Нападения японцев на Перл-Харбор в декабре 1941 года в Японии имелось 24 запатентованных лекарства, содержащих метамфетамин или амфетамин, доступных на рынке.
Японцы называли психостимуляторы 戦力増強剤 (сэнрёку дзо̄кё̄ дзай), что буквально означает лекарства, «повышающие боевой дух», употребление их во время войны считалось проявлением патриотизма.
Императорская армия Японии имела метамфетамин в форме для инъекций, так как при подобном употреблении он начинает действовать быстрее и является более активным.
Известными потребителями метамфетамина являлись также японские камикадзе.
В СССР
В 1940—1941 годах изучались материалы по первитину из Германии, затем профессор О. Ю. Магидсон произвёл первый синтез (из фенилацетона).
Промышленный синтез был налажен в 1946 году, и уже в 1948 году первитин упоминается в справочнике Машковского.
Гидрохлорид метамфетамина выпускался в СССР вплоть до 1970-х годов в виде таблеток по 3 мг под названием первити́н.
Первитин применялся в психиатрической практике как психостимулятор, для лечения нарколепсии и депрессий различного происхождения. Впоследствии, приказом по Министерству здравоохранения СССР от 11 февраля 1954 года он был отнесён к наркотикам, а в 1975 году его производство было прекращено, и он был исключён из фармакопеи.
Как увеличить выработку АТФ
Количество молекул «энергетической» кислоты зависит от количества митохондрий в организме. Есть несколько способов повысить число митохондрий:
- Физические нагрузки. Регулярные тренировки истощают запасы энергии, поэтому требуют большое количество митохондрий для производства АТФ.
- Холод. Опыты на крысах показали, что низкие температуры влияют на число митохондрий.
- Диета с низким содержанием углеводов и высоким содержанием жиров заставляет организм использовать для выработки энергии жиры.
- Добавки, которые помогают митохондриям вырабатывать энергию более эффективно. К ним относят, например, Коэнзим Q10.
Безусловно, организм сам знает, когда выделять нужные ему вещества. Но если вы регулярно занимаетесь спортом или желаете отсрочить наступление старости, то вам стоит ему немного помочь.
Что такое АТФ
Аденозинтрифосфорная кислота это вещество, которое чаще других обновляется в организме. Продолжительность жизни АТФ не более минуты. Поэтому она постоянно рождается и распадается. Так происходит в среднем 3000 раз за сутки. Удивительно, но такое количество обновлений составляет 40 кг. Настолько велика потребность человека в энергии.
Этот нуклеотид состоит из трех компонентов:
- Рибоза – это моносахарид, который входит в состав РНК.
- Аденин – соединение углерода с азотом;
- Трифосфат – остатки фосфорной кислоты.
Молекула АТФ дает энергию для всех процессов, происходящих в организме. Благодаря ее расщеплению сокращаются мышечные волокна. Прежде чем АТФ произведет энергию, она проходит несколько этапов. В процессе расщепления от нее отделяются остатки фосфорной кислоты. Отрыв одной молекулы сопровождается выбросом энергии. Когда отделяется одна молекула фосфорной кислоты, образуется АДФ (аденозиндифосфат), две – АМФ (аденозинмонофосфат).
Синтез молекулы АТФ у человека и животного происходит в митохондриях. Топливом для синтеза выступает глюкоза. Когда запасы гликогена на исходе, начинают задействоваться жировые ресурсы. Спортсмены знают, что для расхода жировых запасов требуются аэробные нагрузки. К ним относятся бег, ходьба, пешие прогулки, катание на коньках и другие.
Система гуанилатциклаза-цГМФ. Система фосфолипаза С — инозитол-3-фосфат.
Система гуанилатциклаза-цГМФ.
Активация мембранной гуанилатциклазы происходит не под непосредственным влиянием гормон-рецепторного комплекса, а опосредованно через ионизированный кальций и ок-сидантные системы мембран. Определяющая эффекты ацетилхолина стимуляция активности гуанилатциклазы также осуществляется опосредованно через Са2+. Через активацию гуанилатциклазы реализует эффект и на-трийуретический гормон предсердий — атриопептид. Путем активации пе-рекисного окисления стимулирует гуанилатциклазу гормон эндотелия сосудистой стенки оксид азота — расслабляющий эндотелиальный фактор. Под влиянием гуанилатциклазы из ГТФ синтезируется цГМФ, активирующий цГМФ-зависимые протеинкиназы, которые уменьшают скорость фосфорилирования легких цепей миозина в гладких мышцах стенок сосудов, приводя к их расслаблению. В большинстве тканей биохимические и физиологические эффекты цАМФ и цГМФ противоположны. Примерами могут служить стимуляция сокращений сердца под влиянием цАМФ и торможение их цГМФ, стимуляция сокращения гладких мышц кишечника цГМФ и подавление цАМФ. цГМФ обеспечивает гиперполяризацию рецепторов сетчатки глаза под влиянием фотонов света. Ферментативный гидролиз цГМФ, а следовательно, и прекращение гормонального эффекта, осуществляется с помощью специфической фосфодиэстеразы.
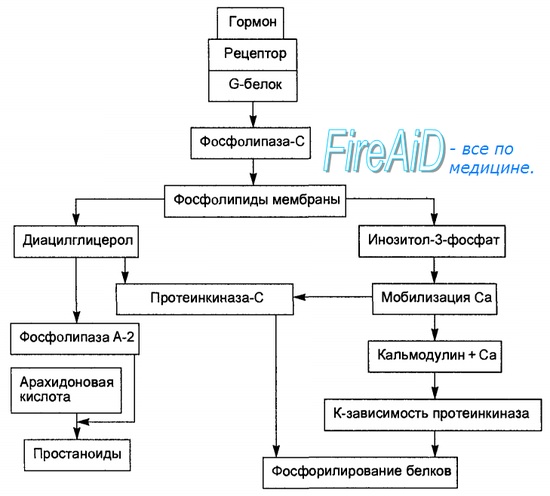
Рис. 6.2. Опосредование гормонального сигнала системой фосфолипаза С—инози-тол-3-фосфат.
Образование гормон-рецепторного комплекса при участии регуляторного G-белка активирует мембранную фосфолипазу С, вызывающую гидролиз фосфолипидов мембраны с образованием двух вторичных посредников: инозитол-3-фосфата и диацилглицерола. Инозитол-3-фосфат ведет к выходу Са2+ из внутриклеточных депо. Связывание ионизированного кальция со специализированным белком кальмодулином активирует протеинкиназы и вызывает фосфорили-рование внутриклеточных структурных белков и ферментов. Диацилглицерол повышает сродство протеинкиназы С к Са2+, способствуя ее активации, что также завершается процессами фосфорилирования белков. Диацилглицерол одновременно реализует другой путь опосредования гормонального эффекта, активируя фосфолипазу А-2 и образование простаноидов.
Система фосфолипаза С — инозитол-3-фосфат.
Гормонрецепторный комплекс с участием регуляторного G-белка ведет к активации мембранного фермента фосфолипазы С, вызывающей гидролиз фосфоли-пидов мембраны с образованием двух вторичных посредников: инозитол-3-фосфата и диацилглицерола. Инозитол-3-фосфат вызывает выход Са2+ из внутриклеточных депо, в основном из эндоплазматического ретикулума, ионизированный кальций связывается со специализированным белком кальмодулином, что обеспечивает активацию протеинкиназ и фосфорили-рование внутриклеточных структурных белков и ферментов. В свою очередь диацилглицерол способствует резкому повышению сродства протеинкиназы С к ионизированному кальцию, последний без участия кальмоду-лина ее активирует, что также завершается процессами фосфорилирования белков. Диацилглицерол одновременно реализует и другой путь опосредования гормонального эффекта за счет активирования фосфолипазы А-2. Под влиянием последней из мембранных фосфолипидов образуется арахи-доновая кислота, являющаяся источником мощных по метаболическим и физиологическим эффектам веществ — простагландинов и лейкотриенов. В разных клетках организма превалирует один или другой путь образования вторичных посредников, что в конечном счете и определяет физиологический эффект гормона. Через рассмотренную систему вторичных посредников реализуются эффекты адреналина (при связи с альфа-адренорецепто-ром), вазопрессина (при связи с V-1-рецептором), ангиотензина-И, соматостатина, окситоцина.
Роль цАМФ в бактериальных клетках[править | править код]
В бактериях уровень цАМФ изменяется в зависимости от среды культивирования. В частности, уровень цАМФ низок, если в качестве источника углерода используется глюкоза. Это регулируется через ингибирование цАМФ-образующего фермента, аденилатциклазы, как побочный продукт транспорта глюкозы в клетку. Транскрипционный фактор CRP (cAMP receptor protein), также называемый CAP (активатный белок генов катаболизма) формирует комплекс с цАМФ и таким образом становится возможным его связывание с ДНК. Комплекс CRP-цАМФ увеличивает экспрессию большого количества генов, включая некоторые ферменты, ответственные за запасание энергии независимо от глюкозы.
цАМФ, к примеру, вовлечен в положительную регуляцию lac оперона. В среде с низкой концентрацией глюкозы, цАМФ накапливается и связывается с аллостерическим сайтом транскрипционного регулятора CRP. Этот белок переходит в активную форму и связывается со специфическим сайтом левее lac промотора, облегчая посадку РНК полимеразы на соседний промотер для старта транскрипции с lac оперона, увеличивая скорость транскрипции lac оперона. При высокой концентрации глюкозы, концентрация цАМФ падает, и CRP диссоциирует из lac оперона.
Пути синтеза
В организме АТФ синтезируется путём фосфорилирования АДФ:
- АДФ + H3PO4 + энергия → АТФ + H2O.
Фосфорилирование АДФ возможно тремя способами:
- субстратное фосфорилирование,
- окислительное фосфорилирование,
- фотофосфорилирование в процессе фотосинтеза у растений.
В первых двух способах используется энергия окисляющихся веществ. Основная масса АТФ образуется на мембранах митохондрий в ходе окислительного фосфорилирования H-зависимой АТФ-синтазой. Субстратное фосфорилирование АДФ не требует участия мембранных ферментов, оно происходит в цитоплазме в процессе гликолиза или путём переноса фосфатной группы с других макроэргических соединений.
Реакции фосфорилирования АДФ и последующего использования АТФ в качестве источника энергии образуют циклический процесс, составляющий суть энергетического обмена.
В организме АТФ является одним из самых часто обновляемых веществ; так, у человека продолжительность жизни одной молекулы АТФ менее 1 мин. В течение суток одна молекула АТФ проходит в среднем 2000—3000 циклов ресинтеза (человеческий организм синтезирует около 40 кг АТФ в день, но содержит в каждый конкретный момент примерно 250 г), то есть запаса АТФ в организме практически не создаётся, и для нормальной жизнедеятельности необходимо постоянно синтезировать новые молекулы АТФ.
АТФ – универсальный источник энергии
АТФ расшифровывается как аденозинтрифосфат, или аденозинтрифосфорная кислота. Вещество является одним из двух наиболее важных источников энергии в любой клетке. Строение АТФ и биологическая роль тесно связаны. Большинство биохимических реакций может протекать только при участии молекул вещества, особенно это касается пластического обмена. Однако АТФ редко непосредственно участвует в реакции: для протекания любого процесса нужна энергия, заключенная именно в химических связях аденозинтрифосфата.
Строение молекул вещества таково, что образующиеся связи между фосфатными группами несут огромное количество энергии. Поэтому такие связи также называются макроэргическими, или макроэнергетическими (макро=много, большое количество). Термин макроэргические связи впервые ввел ученый Ф. Липман, и он же предложил использовать значок ̴ для их обозначения.
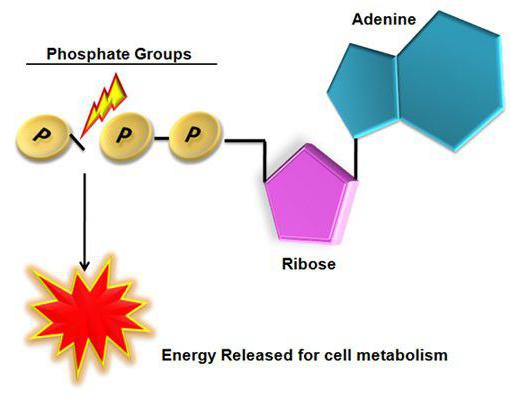
Очень важно для клетки поддерживать постоянный уровень содержания аденозинтрифосфата. Особенно это характерно для клеток мышечной ткани и нервных волокон, потому что они наиболее энергозависимы и для выполнения своих функций нуждаются в высоком содержании аденозинтрифосфата
cAMP (цАМФ) Система
3′,5′-CYCLIC AMP
АМФ циклический (cAMP; структурную формулу см. рис.43 ) является универсальным посредником передачи внутриклеточного сигнала с
внешней стороны клеточной мембраны к эффекторным
системам клетки, действие которых вызывает генерализованную реакцию
клетки на воздействие внешнего биологически-активного вещества, например
гормона.
цАМФ синтезируется из АТФ при посредстве фермента аденилатциклазы .
цАМФ — основной
вторичный посредник . В течение некоторого времени после открытия цАМФ
в 1950 году он считался вторичным месенджером для всех гидрофильных
гормонов. Связывание этих гормонов с рецептором увеличивает содержание цАМФ
в клетке в результате активации фермента аденилатциклазы , превращающего АТФ (
аденозинтрифосфат ) цАМФ (
рис.1-9сер ). цАМФ затем стимулирует второй фермент, протеинкиназу , которая фосфорилирует
ряд других белков. Последние обычно являются ферментами, которые существуют
в активной и неактивной формах, в зависимости от того, подверглись они
фосфорилированию или нет.
Таким образом, гормоны, которые действуют
через цАМФ, осуществляют свою биологическую функцию путем фосфорилирования специфических ферментов и
посредством этого изменяют (увеличивают или уменьшают) их активность.
Наконец, должен существовать некий механизм удаления внутриклеточного цАМФ,
после того как гормон прекращает свое существование. Это удаление
осуществляется вездесущим ферментом,
фосфодиэстеразой , которая превращает цАМФ в неактивный метаболит аденозинмонофосфат ( АМФ ).
В ряде случаев
внеклеточные лиганды после взаимодействия с рецепторами индуцируют
образование вторичных мессенджеров через участие GTP-связывающих и
GTP-гидролизующих гетеродимерных белков, названных
G-белками.
В этих системах имеет место последовательность реакций,
отображенная на рис. I.23,а.
Внеклеточный лиганд специфически распознается трансмембранным рецептором,
который, в свою очередь, активирует соответствующий
G-белок, локализованный на цитоплазматической поверхности мембраны.
Активированный G-белок изменяет активность эффектора (фермента или белка
ионного канала, в данном случае —
аденилатциклазы), который повышает внутриклеточную концентрацию
вторичного мессенджера (в данном примере — cAMP). Каждый вид рецептора
взаимодействует только с определенным представителем семейства G-белков, а
каждый G-белок — со специфическим классом эффекторных молекул. Таким
образом, в одном конкретном случае гормон или нейромедиатор, реагируя со
своим рецептором, вызывает активацию GS-белка, стимулирующего
аденилатциклазу. Этот фермент-эффектор превращает внутриклеточный ATP в
cAMP — классический вторичный мессенджер. Внутриклеточный уровень cAMP
может специфически понижаться под действием фосфодиэстеразы, которая
превращает cAMP в 5′-AMP.
cAMP активирует множество cAMP-зависимых
протеинкиназ, каждая из которых фосфорилирует определенные белки-субстраты.
В большинстве клеток животных присутствуют две cAMP-зависимые
протеинкиназы, фосфорилирующие белки-мишени по остаткам Ser и Thr ( серин/треониновые киназы ).
Специфичность регуляторных воздействий cAMP обеспечивается наличием в
клетках определенных типов только им присущих тканеспецифических белков,
являющихся субстратами для A-киназ. Например, клетки печени обогащены
фосфорилазой-киназой и гликогенсинтазой, активность которых регулируется
избирательным фосфорилированием по cAMP-зависимому механизму, что
сопровождается накоплением или освобождением углеводов в гепатоцитах,
адипоциты обогащены липазой, фосфорилирование которой по тому же механизму
приводит к освобождению жирных кислот, и т.д.
При понижении
концентрации гормонов во внеклеточной среде внутриклеточное содержание сАМР
быстро уменьшается, так как фосфодиэстераза превращает сАМР в 5′-AMP.
Одновременно происходит дефосфорилирование белков-мишеней A-киназ под
действием фосфатаз . Активность некоторых
фосфатаз также регулируется по cAMP- зависимому механизму. Кроме того,
большинство клеток синтезирует белок,
названный ингибитором протеинкиназы (PKI), который блокирует активность
C-субъединиц A-киназы. Это сопровождается инактивацией соответствующих
факторов транскрипции и подавлением экспрессии регулируемых ими генов.
Образование
Формирование молекулы происходит в митохондриях и хлоропластах. Основополагающий момент в молекулярном синтезе кислоты – диссимиляционный процесс. Диссимиляция – процесс перехода сложного соединения до относительно простого за счет разрушения.
В рамках синтеза кислоты принято выделять несколько стадий:
- Подготовительная. Основа расщепления – пищеварительный процесс, обеспечивается за счет ферментативного действия. Распаду подвергается пища, попавшая в организм. Происходит жировое разложение до жирных кислот и глицерина. Белки распадаются до аминокислот, крахмал – до образования глюкозы. Этап сопровождается выделением энергии теплового характера.
- Бескислородная, или гликолиз. В основе лежит процесс распада. Происходит глюкозное расщепление с участием ферментов, при этом 60% выделяемой энергии превращается в тепло, остальная часть остается в составе молекулы.
- Кислородная, или гидролиз, Осуществляется внутри митохондрий. Происходит с помощью кислорода и ферментов. Участвует выдыхаемый организмом кислород. Завершается полной диссимиляцией. Подразумевает энергетическое выделение для формирования молекулы.
Существуют следующие пути молекулярного образования:
- Фосфорилирование субстратного характера. Основано на энергии веществ в результате окисления. Превалирующая часть молекулы формируется в митохондриях на мембранах. Осуществляется без участия ферментов мембраны. Совершается в цитоплазматической части посредством гликолиза. Допускается вариант образования за счет транспортировки фосфатной группы с иных макроэргических соединений.
- Фосфорилирование окислительного характера. Происходит за счет окислительной реакции.
- Фотофосфорилирование у растений в ходе фотосинтеза.
Сущность понятия
 Перед изучением понятия АТФ необходима его расшифровка. Данный термин означает нуклеозидтрифосфат, который существенно значим для энергетического и вещественного обмена в составе организма.
Перед изучением понятия АТФ необходима его расшифровка. Данный термин означает нуклеозидтрифосфат, который существенно значим для энергетического и вещественного обмена в составе организма.
Это уникальный энергетический источник, лежащий в основе биохимических процессов. Данное соединение является основополагающим для ферментативного образования.
АТФ был открыт в Гарварде в 1929 году. Основоположниками стали ученые Гарвардской медицинской школы. В их число вошли Карл Ломан, Сайрус Фиске и Йеллапрагада Суббарао. Они выявили соединение, которое по строению напоминало адениловый нуклеотид рибонуклеиновых кислот.
Отличительной особенностью соединения было содержание трех остатков фосфорной кислоты вместо одного. В 1941 году ученый Фриц Липман доказал, что АТФ имеет энергетический потенциал в пределах клетки. Впоследствии был обнаружен ключевой фермент, который получил название АТФ-синтаза. Его задача – образование в митохондриях кислотных молекул.
АТФ – это энергетический аккумулятор в клеточной биологии, является обязательным для успешного осуществления биохимических реакций.
 Биология аденозинтрифосфорной кислоты предполагает ее образование в результате энергетического обмена. Процесс состоит из создания 2 молекул на второй стадии. Остальные 36 молекул появляются на третьем этапе.
Биология аденозинтрифосфорной кислоты предполагает ее образование в результате энергетического обмена. Процесс состоит из создания 2 молекул на второй стадии. Остальные 36 молекул появляются на третьем этапе.
Скопление энергии в структуре кислоты происходит в связующей части между остатками фосфора. В случае отсоединения 1 фосфорного остатка происходит энергетическое выделение 40 кДж.
В результате кислота превращается в аденозиндифосфат (АДФ). Последующее фосфатное отсоединение способствует появлению аденозинмонофосфата (АМФ).
Следует отметить, цикл растений предусматривает повторное использование АМФ и АДФ, в результате которого происходит восстановление этих соединений до состояния кислоты. Это обеспечивается процессом фотосинтеза.
История появления
В 1893 году японский ученый Нагаи Нагаеси вычленил метамфетамин из химических соединений эфедрина. Кристаллическую форму наркотического вещества синтезировали только в 1919 году. Начиная с 30-х годов первитин в таблетках употребляли военнослужащие Германии. Сам Гитлер получал дозу препарата ежедневно для повышения физической и умственной активности.
Японские фармацевты в годы Второй мировой войны легально поставляли на рынок около 24 видом лекарств, в основе которых был метамфетамин. Императорские военные считали Первитин средством для повышения боевого духа и патриотизма.
С 1948 по 1970 гг. синтезированный препарат в виде таблеток по 3 мг применялся в СССР. Его назначали психиатры своим пациентам, страдающим затяжной депрессией и другими нервными расстройствами. В 1975 году метамфетамин прекратили производить из-за выявления наркотических свойств.
структура
АТФ, как следует из его названия, является нуклеотидом с тремя фосфатами. Его особая структура, особенно две пирофосфатные связи, делают его энергетически богатым соединением. Он состоит из следующих элементов:
— Азотистое основание, аденин. Азотистые основания представляют собой циклические соединения, которые содержат в своей структуре один или несколько атомов азота. Мы также находим их в качестве компонентов в нуклеиновых кислотах, ДНК и РНК.
— Рибоза находится в центре молекулы. Это сахар пентозного типа, поскольку в нем пять атомов углерода. Его химическая формула C5H10О5. Углерод 1 рибозы присоединен к адениновому кольцу.
— Три фосфатных радикала. Последние два являются «звеньями высокой энергии» и представлены в графических структурах символом virgulilla: ~. Фосфатная группа является одной из наиболее важных в биологических системах. Три группы называются альфа, бета и гамма, от ближайшего к дальнему.
Эта связь очень лабильна, поэтому она разделяется быстро, легко и спонтанно, когда этого требуют физиологические условия организма. Это происходит потому, что отрицательные заряды трех фосфатных групп пытаются постоянно отходить друг от друга..
Медицинское применение Править
Общая информация Править
Благодаря стойкости в организме эффекты амфетамина длительны и сохраняются при приёме его внутрь.
Амфетамин обладает также периферической адренергической активностью (стимулирует a- и b-адренорецепторы); он вызывает сужение периферических сосудов, усиление сокращений сердца, повышение артериального давления, расслабление мускулатуры бронхов, расширение зрачков. Эти эффекты более продолжительны, но менее выражены, чем у адреналина.
При правильном дозировании амфетамин, усиливая процессы возбуждения в ЦНС, уменьшает чувство утомления, оказывает общее возбуждающее влияние, выражающееся в улучшении настроения, ощущении прилива сил, бодрости, повышении работоспособности, уменьшении потребности в сне.
Амфетамин и его аналоги ослабляют и укорачивают сон, вызванный снотворными и наркотиками, в связи с чем их называют иногда пробуждающими аминами.
Препарат обладает анорексигенной активностью, то есть уменьшает аппетит и способствует более быстрому наступлению чувства насыщения пищей.
В России немедицинское применение амфетамина запрещено.
Назначают амфетамин внутрь взрослым по 0,005—0,01 г (5—10 мг) 1—2 раза в день. Действие после однократного приёма длится 2—8 ч.
Дозы необходимо подбирать индивидуально из-за различной чувствительности и переносимости
Из организма препарат выводится медленно, возможны явления кумуляции.
Амфетамин должен применяться с осторожностью и только по медицинским показаниям. При передозировке препарата могут возникнуть головокружение, озноб, тошнота, потеря аппетита, бессонница, тахикардия, аритмии.
При длительном бесконтрольном применении возможны тяжёлые нервнопсихические расстройства вплоть до шизофреноподобных психозов.
При приёме амфетамина во второй половине дня может нарушиться сон.
Отпускается (в странах, где его применение разрешено) строго по рецепту врача, имеющего соответствующую лицензию.
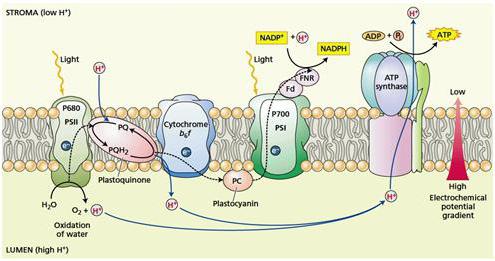
Фотофосфорилирование
Процесс фотофосфорилирования — это то же окислительное фосфорилирование лишь с одним отличием: реакции фотофосфорилирования протекают в хлоропластах клетки под действием света. АТФ образуется во время световой стадии фотосинтеза – основного процесса получения энергии у зеленых растений, водорослей и некоторых бактерий.
В процессе фотосинтеза все по той же электронно-транспортной цепи проходят электроны, в результате чего формируется протонный градиент. Концентрация протонов на одной из сторон мембраны является источником синтеза АТФ. Сборка молекул осуществляется посредством фермента АТФ-синтазы.