Эфир для наркоза, показания, принцип действия препарата
Содержание:
Номенклатура
Рекомендации ИЮПАК позволяют при присвоении названий простым эфирам вида R-O-R’ использовать разные типы номенклатуры:
- заместительную — когда группа R’-O- считается заместителем в родоначальном углеводороде RH;
- радикало-функциональную — называя функцию словом «эфир» (название «оксид» не рекомендуется) и перечисляя названия радикалов R и R’ в виде приставок;
- умножительную (если R и R’ циклические);
- заменительную;
- номенклатуру фанов.
Заместительная номенклатура является предпочтительной. В этом случае один из радикалов (R) выполняет роль родоначального углеводорода (RH) и получает название, соответствующее этому углеводороду. Группа R’O- считается заместителем, и её название образуется слиянием названия радикала R’ и приставки окси, например:
- CH3CH2CH2CH2CH2O- — пентилокси-.
В нескольких случаях за заместителем R’O- сохранено традиционное название:
- CH3O- — метокси-; CH3CH2O- — этокси-; CH3CH2CH2O- — пропокси-; CH3CH2CH2CH2O- — бутокси-; C6H5O- — фенокси-; (CH3)3CO- — трет-бутокси-; (CH3)2CHO- — изопропокси-.
В таком случае полные названия простых эфиров выглядят следующим образом:
- CH3OCH3 — метоксиметан;
- CH3CH2OCH3 — метоксиэтан;
- PhOCH3 — метоксибензол (также: анизол).
В радикало-функциональной номенклатуре названия заместителей перед словом «эфир» перечисляются в алфавитном порядке:
- CH3OCH3 — диметиловый эфир;
- CH3CH2OCH3 — метилэтиловый эфир;
- PhOCH3 — метилфениловый эфир.
Заменительную номенклатуру удобно использовать в случае полиэфиров. В этом случае соединение называется как углеводород, а место, где углеродный атом формально заменён кислородом, называют в виде приставки «окса»-:
- CH3OCH2CH2OCH2CH2OCH2CH2OCH3 — 2,5,8,11-тетраоксадодекан;
- (по заместительной номенклатуре: 1-метокси-2-этан).
В редких случаях, когда оба заместителя в простом эфире являются циклическими, можно использовать умножительную номенклатуру:
- PhOPh — 1,1′-оксидибензол.
Побочные эффекты
Самая тяжелая стадия – выход из наркозного состояния, вызванного эфиром. Человек еще полностью не пришел в себя, но его сильно тошнит, ему тяжело дышать из-за слизи в бронхах, он много кашляет. Плюс головные боли и головокружение. Когда пациент окончательно очнулся, ему становится легче, но остаточные явления сохраняются еще примерно на сутки.
У некоторых пациентов побочные эффекты распространяются и на поздний реабилитационный период. В течение месяца человек периодически испытывает головные боли и рассеянность, ему сложно концентрироваться, он быстро устает. Все это – результат нарушения мозговой деятельности эфирными веществами, которые постепенно полностью выходят из организма.
Свойства
- Бесцветная, прозрачная, очень подвижная, летучая жидкость со своеобразным запахом и жгучим вкусом.
- Растворимость в воде 6,5 % при 20 °C. Образует азеотропную смесь с водой (т. кип. 34,15 °C; 98,74 % диэтилового эфира). Смешивается с этанолом, бензолом, эфирными и жирными маслами во всех соотношениях.
- Легко воспламеняется, в том числе пары; в определённом соотношении с кислородом или воздухом пары эфира для наркоза взрывоопасны.
- Разлагается под действием света, тепла, воздуха и влаги с образованием токсичных альдегидов, пероксидов и кетонов, раздражающих дыхательные пути.
- Образующиеся пероксиды нестойки и взрывоопасны, они могут быть причиной самовоспламенения диэтилового эфира при хранении и взрыве при его перегонке «досуха»
По химическим свойствам диэтиловый эфир обладает всеми свойствами, характерными для простых эфиров, например, образует нестойкие оксониевые соли с сильными кислотами:
-
- (C2H5)2O+HBr→(C2H5)2OH+Br−{\displaystyle {\mathsf {(C_{2}H_{5})_{2}O+HBr\rightarrow ^{+}Br^{-}}}}
Образует сравнительно стабильные комплексные соединения с кислотами Льюиса: (C2H5)2O·BF3
Литература
- Бабаян Э. А., Гаевский А. В., Бардин Е. В. «Правовые аспекты оборота наркотических, психотропных, сильнодействующих, ядовитых веществ и прекурсоров» М.: МЦФЭР, 2000 стр. 148
- Гурвич Я. А. «Справочник молодого аппаратчика-химика» М.: Химия, 1991 стр. 229
- Девяткин В. В., Ляхова Ю. М. «Химия для любознательных, или о чём не узнаешь на уроке» Ярославль: Академия Холдинг, 2000 стр. 48
- Рабинович В. А., Хавин З. Я. «Краткий химический справочник» Л.: Химия, 1977 стр. 148
- Гауптман 3., Органическая химия, пер. с нем., М.: Химия, 1979, с. 332-40;
- Грефе Ю., Общая органическая химия, пер. с англ., т. 2, М., 1982, с. 289—353;
- Ремане X.,Kirk-Othmer encyclopedia, v. 9, N. Y., 1980, p. 381-92.
Показания к применению
ингаляционная общая анестезия по открытой (капельно), полуоткрытой, полузакрытой и закрытой системам (в основном при кратковременных хирургических вмешательствах);поддержание общей анестезии при проведении комбинированной общей анестезии с применением психоактивных лекарственный средств и периферических миорелаксантов.
Дозировка
При полуоткрытой системе, 2-4 об.% эфира во вдыхаемой смеси поддерживают анальгезию и выключение сознания, 5-8 об.% – поверхностный наркоз, 10-12 об.% – глубокий наркоз. Для усыпления больного могут потребоваться концентрации до 20-25 об.%.
Наркоз эфиром проводят открытым масочным капельным способом или аппаратным способом (также с применением маски), добавляя кислород (не менее 1 л/мин.) Начинают наркоз с подачи эфира в концентрации 1 об%, затем постепенно-увеличивают концентрацию до 10-12 об%, а у некоторых постепенно увеличивают до 16-18 об%. Наркотический сон наступает через 12-20 мин, в дальнейшем поддерживают наркоз концентрацией 2-4 об%. По окончании наркоза больного переводят на дыхание воздухом, обогащенным кислородом.
Побочное действие
Со стороны сердечно-сосудистой системы и крови (кроветворение, гемостаз): тахикардия или брадикардия, вплоть до остановки сердца; аритмии; гипер- или гипотензия; коллапс; кровоточивость.
Со стороны органов желудочно-кишечного тракта: гиперсаливация, тошнота, рвота, понижение тонуса и моторики ЖКТ, паралитический илеус (при длительном наркозе), транзиторная желтуха, изменения печеночных проб.
Со стороны нервной системы и органов чувств: возбуждение, двигательная активность, редко – судороги у детей, сонливость, депрессия (после операции).
Прочие: метаболический ацидоз, гипоальбуминемия, гипогаммаглобулинемия, снижение клубочковой фильтрации и диуреза, альбуминурия.
Противопоказания
гиперчувствительность;острые заболевания дыхательных путей;черепномозговая гипертензия;артериальная гипертензия;хроническая сердечная недостаточность;печеночная и/или почечная недостаточность;кахексия;сахарный диабет;ацидоз;необходимость проведения в ходе хирургического вмешательства электрокоагуляции или электроножа.
С осторожностью: операции на челюстно-лицевой области (из-за взрывоопасноти), масочный наркоз с использованием только эфира, детский возраст, беременность и кормление грудью
Показания и противопоказания к применению
Особенность данного лекарственного средства – это его широкий спектр терапевтического воздействия. Эфир для наркоза используют для:
- снижения восприимчивости к эпинифрину и норэпинифрину;
- временного (до 24 часов) уменьшения объема циркулирующей крови на 10%, замедления работы печени, почек, перистальтики кишечника;
- расслабления скелетной мускулатуры;
- повышения уровня катехоламинов в крови, компенсирующих уменьшение сокращений миокарда;
- легкого управления глубиной сна пациента (во время хирургического вмешательства).
Данный препарат применяют при необходимости использования ингаляционного наркоза закрытого или полуоткрытого типа. Пациентам противопоказано применение эфирной анестезии при:
- сахарном диабете;
- ацидозе;
- печеночной, сердечной или почечной недостаточности;
- кахексии;
- внутричерепной или артериальной гипертензии;
- гиперчувствительности к эфиру;
- острых форм болезни дыхательных путей.
Такую анестезию нельзя применять в случае, если во время операции будет использоваться электронож или проводиться электрокоагуляция. Пациент может испытывать гиперсекрецию легких, рвоту, тошноту, повышение артериального давления, приступы кашля, психомоторное возбуждение.
После операции под диэтиловым эфиром может возникнуть:
- периферическая невропатия конечностей;
- трахеит;
- головные боли;
- бронхит;
- центральная гипертермия;
- бронхопневмония;
- сильная рвота;
- ларингит.
Применение[править | править код]
Фармакологияправить | править код
В медицине используется в качестве лекарственного средства , так как его влияние на нейронные мембраны и свойство «обездвиживать» ЦНС очень специфично и полностью обратимо. Применяется в хирургической практике для ингаляционного наркоза, а в стоматологической практике — местно, для обработки кариозных полостей и корневых каналов зуба при подготовке к пломбированию.
В связи с медленным разложением диэтилового эфира, должны строго выдерживаться установленные сроки хранения. Для наркоза можно применять эфир только из склянок, открытых непосредственно перед операцией. По истечении каждых 6 месяцев хранения эфир для наркоза проверяют на соответствие требованиям. Использование технического эфира в этих целях не допускается.
Выдающийся отечественный хирург Н.И. Пирогов первым в истории медицины начал оперировать раненых с эфирным обезболиванием в полевых условиях и всего провел около десяти тысяч операций под эфирным наркозом.
Техникаправить | править код
Диэтиловый эфир — аэрозоль для быстрого запуска.Инструкция утверждает, что возможен запуск при температуре −55 °F (−48,3 °C)
- Применяется как растворитель нитратов целлюлозы в производстве бездымного пороха, природных и синтетических смол, алкалоидов.
- Применяется как теплоноситель в криогенной технике, реже как компонент для хладагентов.
- Применяется как экстрагент для разделения плутония и продуктов его деления при получении и переработке ядерного топлива, при выделении урана из руд.
- Применяется как компонент топлива в авиамодельных компрессионных двигателях.
- При запуске бензиновых двигателей внутреннего сгорания в суровых зимних условиях.
В СССР выпускалась пусковая жидкость «Арктика», небольшое количество заливалось во впускной коллектор через карбюратор при снятом воздушном фильтре. Для армии выпускался эфир в алюминиевой запечатанной гильзе, перед использованием гильза протыкалась штык-ножом или отвёрткой. За рубежом выпускается «жидкость для запуска в холодные дни» в аэрозольном баллоне. Состав: диэтиловый эфир, индустриальное масло, пропеллент.
Механизм запуска ДВС в этом случае по большей мере компрессионный: смесь эфира с воздухом воспламеняется от сжатия уже при степени сжатия порядка 5-6. Потерявшие компрессию по разным причинам двигатели могут делать несколько оборотов на эфире, но на бензине, тем не менее, не работают.
Классы соединений под названием «Эфир»
Изначально все классы соединений, относящиеся к эфирам, так и назывались – эфиры, не было разделения на три группы, которые существуют на сегодняшний день:
- Простые эфиры — это класс соединений, в которых между двух углеводородных радикалов находится кислород, то есть, оба радикала имеют по связи с одним и тем же кислородом. Наиболее известным представителем этого класса является этиловый эфир.
- Сложные эфиры — так называют производные карбоновых и минеральных кислот (так называемых оксикислот), у которых в молекуле вместо гидроксильной группы (-ОН) кислой функции находится спиртовой остаток. Безусловно, определение сложное и непонятное, общая формула таких соединений: R-C(=O)-R’. Представителями являются этилацетат, бутилбутират, бензилформиат.
- Полиэфиры — это класс высокомолекулярных соединений. Их получают в результате поликонденсации многоосновных кислот, то есть они содержат два атома и более водорода. Например, соляная кислота — HCl — одноосновная кислота, азотная — HNO3 — тоже. А вот серная — H2SO4 — и фосфорная — H3PO4 — многоосновные (серная — двухосновная, фосфорная — трех), как и их альдегиды с многоатомными спиртами (у этих спиртов две и более гидроксильных -ОН групп).
Физические свойства и строение
Диэтиловый эфир в бутылке
Физические свойства
Эфиры — бесцветные, подвижные, легкокипящие жидкости с характерным запахом. Эфиры малорастворимы в воде, но хорошо растворяются в органических растворителях и сами растворяют органические соединения.
Строение молекул
Валентный угол в молекулах простых эфиров
Строение молекул простых эфиров схоже со строением молекулы воды. Валентный угол С–O–C в диметиловом эфире составляет 112°. Атом кислорода имеет sp3-гибридизацию.
Спектральные свойства
Характеристической полосой простых эфиров в инфракрасном спектре является полоса при 1150–1080 см–1, соответствующая колебаниям группы C–O–C.
В спектрах 1Н ЯМР группа CH3O алкиловых эфиров имеет сигнал при 3,3-4,0 м. д., а та же группа метилариловых эфиров — при 3,7 м. д. Сигналы протонов двойной связи в виниловых эфирах (вида СН=СН–О) находятся при 5,7-7,5 м. д. (α-положение) и 3,5-5,0 м. д. (β-положение). Если сравнивать эти значения с положением сигналов в аналогичной углеводородной системе СН=СН–С, то сигнал α-углеродного атома оказывается смещённым на +1,2 м. д., а сигнал β-углеродного атома — на –1 м. д.
В спектрах 13C ЯМР насыщенных простых эфиров атом углерода, находящийся в α-положении от атома кислорода, даёт сигнал в области 50-100 м. д., а более удалённые атомы углерода — в области 10-60 м. д. У виниловых эфиров углероды двойной связи (С=С–О) дают сигналы при 115-165 м. д. (α-положение) и 70-120 м. д. (β-положение). При этом, если сравнивать спектры с углеводородными системами типа С=С–С, то сигнал α-углеродного атома в виниловых эфирах оказывается смещённым на +15 м. д., а сигнал β-углеродного атома — на –30 м. д. У ароматических простых эфиров сигнал α-углеродного атома кольца наблюдается при 135-155 м. д. (смещение +25 м. д. по сравнению с ареном). Сигналы остальных ароматических атомов углерода при введении эфирной группы смещаются на –15 м. д. (орто-положение), +1 м. д. (мета-положение) и –8 м. д. (пара-положение).
В масс-спектрах алифатических простых эфиров молекулярный ион проявляется в виде слабого сигнала, для ароматических простых эфиров — в виде интенсивного сигнала. Основное направление фрагментации молекулярного иона — разрыв связи между α- и β-углеродными атомами и гетеролитический разрыв связи C–O. В результате возникают ионы с массой (m/z), равной 31, 45, 59… М–46, М–33, М–18.
- R−CH2−O−R′+⋅→R⋅+CH2=O+−R′{\displaystyle {\mathsf {^{+\cdot }\rightarrow R^{\cdot }+CH_{2}\!\!=\!\!O^{+}\!\!-\!\!R’}}}
- R−O−R′+⋅→R−O⋅+R′+{\displaystyle {\mathsf {^{+\cdot }\rightarrow R\!\!-\!\!O^{\cdot }+R’^{+}}}}
Для алкилариловых простых эфиров фрагментация протекает через потерю алкильной цепи. У диариловых эфиров молекулярный ион или ион М–Н теряет группу CO, а также происходит разрыв связи между атомом кислорода и арильным заместителем. Также в ходе масс-спектрометрии простые эфиры претерпевают перегруппировки с отщеплением молекулы спирта либо — в случае ариловых простых эфиров — с отщеплением алкена и образованием фенола.
- PhOCH2CH2R+⋅→PhOH+⋅+CH2=CH−R{\displaystyle {\mathsf {^{+\cdot }\rightarrow ^{+\cdot }+CH_{2}\!\!=\!\!CH\!\!-\!\!R}}}
Фармакологическое действие
Используется в качестве средства для наркоза благодаря своей способности обратимо угнетать центральную нервную систему человека. Наркоз получается со всеми привычными стадиями, при этом отсутствуют все виды чувствительности, сознания нет, мускулатура расслаблена, рефлекторные действия человека угнетены.
Так как диэтиловый спирт для общего наркоза используется вместе с другими средствами, в том числе и с неингаляционными анестетиками, картина наркоза может меняться. Может возникать возбуждение, неустойчивое артериальное давление, дыхание и пульс. Диэтиловый эфир раздражает дыхательные пути, может возникнуть ларингоспазм, кашель, нарушения дыхания, спазм или расслабление бронхов. Слизистая рта также раздражается, обильно выделяется слюна.
Влияет на нормальную деятельность сердечной мышцы. Возможно учащение или урежение числа сокращений сердца, вплоть до его остановки. Провоцирует повышение артериального давления. Эфир присутствует в слюне, и, если такая слюна попадает в желудок, из-за раздражения слизистой оболочки может возникнуть тошнота и рвота. Такое случается как в начале наркоза, так и при пробуждении.
В стадии глубокого хирургического наркоза диэтиловый эфир способен обездвиживать скелетную мускулатуру, уменьшает перистальтику кишечника, увеличивает кровоточивость всех сосудов в теле человека. Вызывает учащение и силу сердечных сокращений, повышает АД, повышает содержание сахара в крови.
Если концентрация диэтилового эфира в организме высока, угнетается сосудодвигательный и дыхательный центры. Давление снижается, а легочное дыхание нарушено. Легкие охлаждаются, и от этого может случиться пневмония. Нарушается обмен веществ, возникает интоксикация.
Когда диэтиловый эфир используется с помощью масочного способа, наступает медленное погружение человека в стадию хирургического наркоза. Пробуждение после наркоза довольно медленное, до 40минут. Так как диэтиловый эфир используется в качестве наркоза вместе с другими препаратами, стадии возбуждения практически нет. Больной не испытывает страха, удушья, и других неприятных ощущений. Мышцы расслабляются, нет депрессии после наркоза. Однако сонливость, слабость и другие признаки угнетения нервной системы присутствуют еще в течении нескольких часов.
Диэтиловый эфир применяют и в стоматологии. Его используют для обработки зубов перед пломбированием. В этих целях обладает слабым анестезирующим и антибактериальным действием. Оказывает подсушивающий эффект, ведь при комнатной температуре диэтиловый эфир быстро испаряется.
Получение
Межмолекулярная дегидратация спиртов
При нагревании первичных спиртов с концентрированной серной кислотой при 130-140 °С образуются простые эфиры. С точки зрения механизма реакции, происходит алкилирование спирта под действием катиона алкоксония ROH+2 или полуэфира серной кислоты ROSO3H.
- 2 CH3CH2OH→96% H2SO4, 135 ∘CCH3CH2OCH2CH3+H2O{\displaystyle {\mathsf {2~CH_{3}CH_{2}OH{\xrightarrow{96\;\%~H_{2}SO_{4},~135~^{\circ }C}}CH_{3}CH_{2}OCH_{2}CH_{3}+H_{2}O}}}
Этот метод пригоден для получения некоторых простейших эфиров: диэтилового, дипропилового, дибутилового эфиров, тетрагидрофурана и диоксана. Недостатком этого метода является то, что вторичные и третичные спирты в этих условиях дегидратируются, превращаясь в алкены. Также он не позволяет получать несимметричные простые эфиры из двух разных спиртов, поскольку при этом получается смесь трёх продуктов.
Промышленным вариантом этой реакции является дегидратация спиртов в газовой фазе над оксидом алюминия, бокситом и другими катализаторами при нагревании до 180-250 °С. Выход эфиров в таких процессах составляет до 75 %.
Реакция алкенов со спиртами
Спирты присоединяются к алкенам в присутствии кислотных катализаторов (серной, фосфорной кислоты, хлороводорода, фторида бора и др.), образуя простые эфиры.
- (CH3)2C=CH2+CH3OH→BF3, 100 ∘C(CH3)2C(OCH3)CH3{\displaystyle {\mathsf {(CH_{3})_{2}C\!\!=\!\!CH_{2}+CH_{3}OH{\xrightarrow{BF_{3},~100~^{\circ }C}}(CH_{3})_{2}C(OCH_{3})CH_{3}}}}
В промышленности таким способом получают простые эфиры из изобутилена либо изоамилена и метанола либо этанола, нагревая их над катионитом в кислой форме. При этом получают трет-бутилметиловый, трет-бутилэтиловый, трет-амилметиловый и трет-амилэтиловый эфиры.
В лабораторных условиях большее значение имеет реакция алкоксимеркурирования алкенов. Она аналогична реакции оксимеркурирования, при помощи которой алкены селективно превращают в спирты, однако в данном случае роль нуклеофильного реагента выполняет не вода, а спирт, который берут в качестве растворителя. Сам алкен вводят в реакцию с ацетатом ртути либо — для получения эфиров со вторичной или третичной алкильной группой — трифторацетатом ртути, а затем полученный продукт демеркурируют при помощи боргидрида натрия. Формально эта реакция представляет собой присоединения спирта по двойной связи согласно правилу Марковникова.
- RCH=CH2→Hg(OAc)2; EtOHRCH(OEt)−CH2−HgOAc→NaBH4RCH(OEt)−CH3{\displaystyle {\mathsf {RCH\!\!=\!\!CH_{2}{\xrightarrow{Hg(OAc)_{2};~EtOH}}RCH(OEt)\!\!-\!\!CH_{2}\!\!-\!\!HgOAc{\xrightarrow{NaBH_{4}}}RCH(OEt)\!\!-\!\!CH_{3}}}}
Реакция Вильямсона
Симметричные и несимметричные простые эфиры можно получить по реакции Вильямсона между алкоголятами и галогеналканами (либо сульфонатами). Эта реакция представляет собой нуклеофильное замещение по механизму SN2, и для неё верны соответствующие закономерности. Например, если в конечном продукте содержится вторичный или третичный заместитель, его следует вводить при помощи алкоголята, а не галогенида, поскольку в ином случае вместо замещения будет происходить реакция элиминирования. Наилучшими галогенидами в этой реакции являются первичные галогениды, а также аллил- и бензилгалогениды.
- (CH3)3COK+CH3I→(CH3)3COCH3{\displaystyle {\mathsf {(CH_{3})_{3}COK+CH_{3}I\rightarrow (CH_{3})_{3}COCH_{3}}}}
- CH3ONa+((CH3)3CCl→(CH3)2C=CH2+NaCl+CH3OH{\displaystyle {\mathsf {CH_{3}ONa+((CH_{3})_{3}CCl\rightarrow (CH_{3})_{2}C\!\!=\!\!CH_{2}+NaCl+CH_{3}OH}}}
Симметричные простые эфиры можно получить из двух молекул галогеналкана в присутствии оксида серебра(I). Так, например, поступают в случае ди-трет-бутилового эфира, который трудно получить другими способами: трет-бутилхлорид вводят в реакцию с карбонатом серебра.
Интерес к реакции Вильямсона связан также с получением краун-эфиров. В этих процессах катион металла в алкоголяте выполняет роль матрицы при сборке макроцикла. Радиус ионов лития, натрия и калия соответствует размеру полости в 12-краун-4, 15-краун-5 и 18-краун-6, и наличие этих катионов сильно повышает выход соответствующих краун-эфиров.
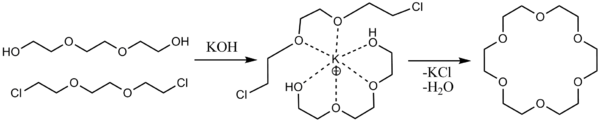
Другие методы
Метиловые простые эфиры получают по реакции спиртов с диазометаном в присутствии кислот Льюиса (фторида бора, хлорида алюминия и др.).
- ROH+CH2N2→Al(OR′)3ROCH3{\displaystyle {\mathsf {ROH+CH_{2}N_{2}{\xrightarrow{Al(OR’)_{3}}}ROCH_{3}}}}
Механизм действия
 Диэтиловый эфир считается малоопасным веществом для здоровья человека. Однако, при употреблении в немедицинских целях препарат вызывает глубокое угнетение нервной системы.
Диэтиловый эфир считается малоопасным веществом для здоровья человека. Однако, при употреблении в немедицинских целях препарат вызывает глубокое угнетение нервной системы.
Различают 4 стадии воздействия эфира на человека:
- Общее обезболивание. Первая стадия опьянения эфиром характеризуется утратой болевой чувствительности, сознание при этом ясное, физические показатели в норме.
- Возбуждение. Эта стадия сопровождается потерей сознания, тем не менее пациенты сильно возбуждены, возрастает двигательная и речевая активность, тонус мышц повышен. Больной может сильно кашлять, вплоть до развития рвотного рефлекса. Дыхание учащается, пульс и давление повышаются.
- Стадия хирургического наркоза. При этой стадии нервная система угнетена, все проявления возбуждения исчезают бесследно – тонус мышц приходит в норму, давление стабилизируется. Эта стадия подразделяется на несколько форм наркоза – легкий, средний, глубокий и сверхглубокий наркоз.
- Агональная стадия. Возникает при передозировке эфиром. В данном случае у больного сильно угнетены дыхательная и сосудодвигательная функции, дыхание поверхностно, пульс – слабый. Больной синеет, его зрачки сильно расширены. Агональная стадия завершается летальным исходом в результате остановки сердечной деятельности и угнетения дыхания.
Опытные анестезиологи, зная о нежелательных проявлениях эфирного наркоза, снимают их при помощи дополнительной премедикации. Наркоманы, используя эфир, не знают о подобных тонкостях, поэтому на неподготовленный организм препарат может оказать сильное воздействие, выражающееся в нарушении восприятия, так называемое диссоциативное действие.
История
Возможно, что впервые диэтиловый эфир был получен в IX веке алхимиком Джабир ибн Хайяном либо алхимиком Раймундом Луллием в 1275 году. Достоверно известно, что он был синтезирован в 1540 году Валерием Кордусом, который назвал его «сладким купоросным маслом» (лат. oleum dulce vitrioli), поскольку получил его перегонкой смеси этилового спирта и серной кислоты, которая тогда называлась «купоросным маслом». Кордус также отметил его анестезирующие свойства. В 1680 году Роберт Бойль вторично синтезировал эфир. Затем в 1704 году Исаак Ньютон открыл эфир в третий раз, в поисках синтеза искусственного золота.
Название «эфир» было дано этому веществу в 1729 году .
В 1794 году эфир был испытан для вдыханий с целью уменьшения болей, а в 1795 году Томас Беддоус создал Медицинский пневматический институт для лечения различных легочных заболеваний газами. Такие газы тогда называли «искусственным воздухом».
приложений
Органический растворитель
Это органический растворитель, который используется для растворения брома, йода и других галогенов; большинство липидов (жиров), смол, чистых каучуков, некоторых алкалоидов, камеди, духов, ацетата целлюлозы, нитрата целлюлозы, углеводородов и красителей.
Кроме того, он используется для экстракции активных компонентов тканей и растений животных, потому что он имеет меньшую плотность, чем вода, и плавает на ней, оставляя нужные вещества растворенными в эфире..
Общая анестезия
Он использовался в качестве общего анестетика с 1840 года, заменив хлороформ для получения терапевтического преимущества. Тем не менее, это легковоспламеняющееся вещество, и, следовательно, сталкивается с серьезными трудностями для его использования в клинических условиях.
Кроме того, он вызывает у пациентов некоторые нежелательные послеоперационные побочные эффекты, такие как тошнота и рвота..
По этим причинам от использования эфира в качестве общего анестетика отказались, заменив его другими анестетиками, такими как галотан..
Дух эфира
Эфир, смешанный с этанолом, использовали для образования раствора, называемого спиртом эфира, который используется для лечения метеоризма желудка и легких форм гастралгии..
Оценка кровообращения
Эфир был использован для оценки кровообращения между рукой и легкими. Эфир вводится в руку, доставляя кровь в правое предсердие, затем в правый желудочек и оттуда в легкие..
Время, прошедшее от впрыска эфира до поглощения запаха эфира в выдыхаемом воздухе, составляет приблизительно 4-6 с..
Учебные лаборатории
Эфир используется в учебных лабораториях во многих экспериментах; например, в демонстрации законов генетики Менделя.
Эфир используется для того, чтобы ошеломить мух рода Drosophila и позволить необходимые пересечения между ними, чтобы выявить законы генетики.